【引言】
纳米材料和纳米技术在最近几年得到了科学界的重视,其在各个领域的应用都越来越广泛。由于纳米材料的特殊的尺寸效应,纳米颗粒、纳米管以及各种纳米技术在生物医学方面的应用正蓬勃发展,势头十足。迄今为止,已经开发了许多纳米系统作为抗生素替代品用于细菌感染的治疗。然而,这些先进的系统由于其非目标聚集性和随后的副作用,因此受到限制。
【成果简介】
近日,国家纳米科学中心王浩研究员和乔增莹副研究员(共同通讯作者)等人论证了病理驱动的自组装纳米结构,由于组装诱导保留(AIR)效应,其在目标位置显示出超强的积累与保留能力。受此效应的启发,本论文论述了一种新的抗菌策略——“活体原位重组装”策略,在酶的辅助下,抗菌活性纳米粒子由球形转变为纤维结构,从而在细菌感染部位同时实现长期积累与增强抗菌的功效。相关成果以题为“An “On-Site Transformation” Strategy for Treatment of Bacterial Infection”发表在Adv. Mater.上。
【图文导读】
图1 CPC的自组装示意图和酶诱导形态转变的原理
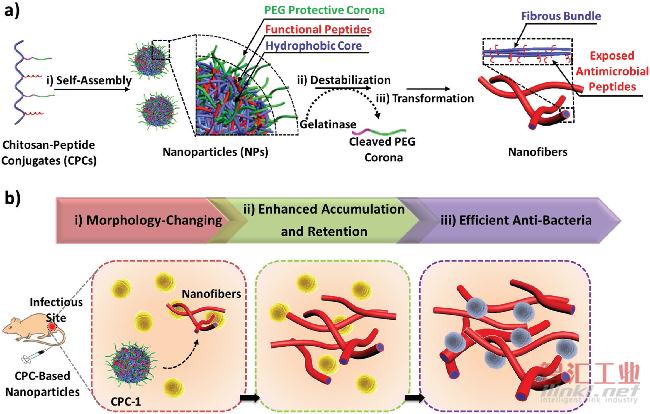
a)i)CPC自组装到含PEG壳层的纳米颗粒中;ii)在明胶酶存在下裂解可降解的肽,从而剥去保护壳层;iii)疏水/亲水平衡的破坏导致壳聚糖的链链氢键相互作用,自发促进纤维结构的自组装重组;
b)i)在感染性微环境中,积累在感染位点的CPC纳米颗粒被由明胶酶阳性细菌产生的明胶酶切割,引发原位形态转化;ii)纤维状纳米结构在感染组织内原位产生,使纳米材料得以积聚且其保留时间延长;iii)外露抗菌肽的纳米纤维显示出高效的抗菌能力。
图2 CPC-1的可变性特征
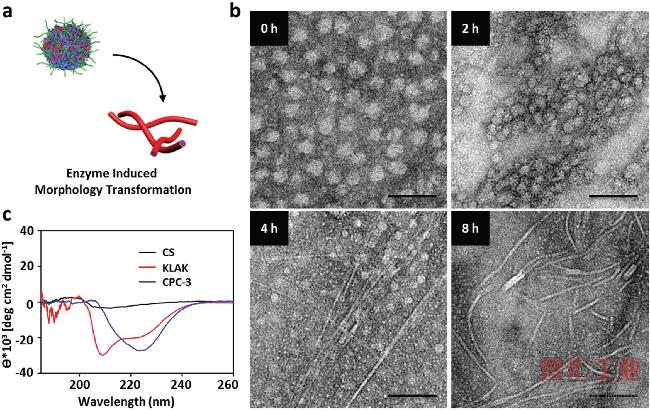
a)CPC-1在酶诱导下的形态转化示意图;
b)将CPC-1纳米粒子浸入明胶酶(10μg/mL)三羟甲基氨基甲烷缓冲溶液(pH 7.4)一段时间后,每个时间段代表性的TEM图像;比例尺,100nm;
c)在PB溶液(10×10-3 M,pH 7.4)中壳聚糖(0.5 mg/mL),KLAK肽和纤维CPC-3(100×10-6M,基于KLAK)的CD光谱。
图3 CPCs的合成方案
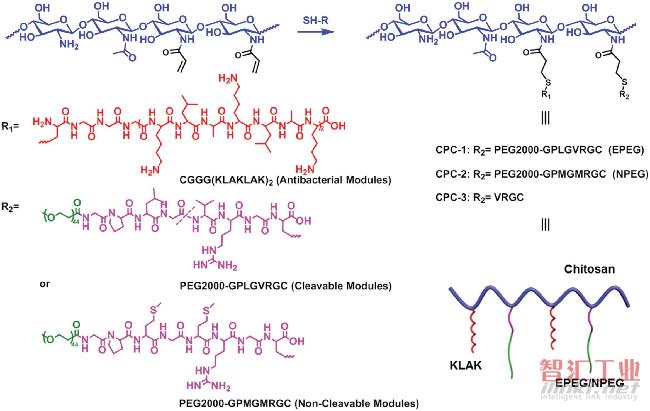
R1代表抗菌肽KLAK;共轭物命名为CPC-1和CPC-2;当R2表示EPEG(具有PEG2000末端的明胶酶切割肽(GPLGVRGC))和NPEG(具有PEG2000末端的对照肽(GPMGMRGC))时。合成物CPC-3是用于模拟明胶酶裂解CPC-1后的产物。
图4 体外CPCs与细菌的相互作用
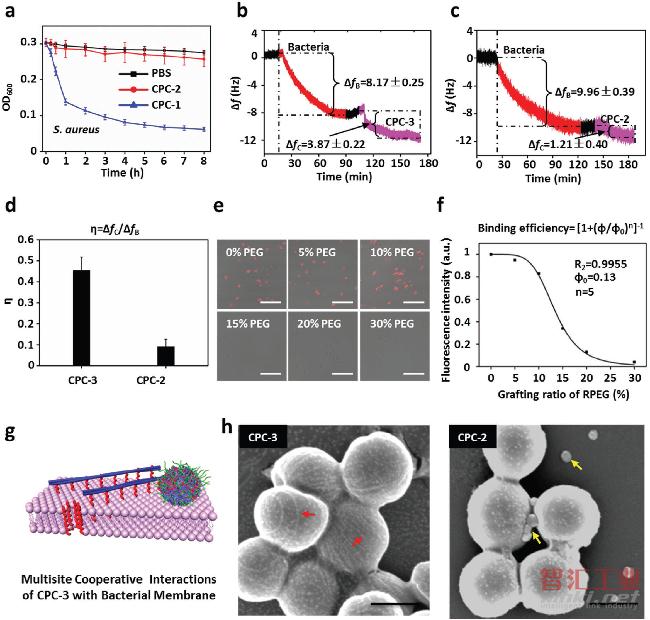
a) 用CPC-1和CPC-2处理过的金黄色葡萄球菌溶液的浑浊度;a) 用CPC-1和CPC-2处理过的金黄色葡萄球菌溶液的浑浊度;
b) 将CPC-3溶液注入石英晶体微天平腔室后,其典型的频率变化曲线。ΔfB和ΔfC分别表示细菌和CPC的频率变化;
c) 将CPC-2的不同溶液注入石英晶体微天平腔室后,频率变化的典型曲线。ΔfB和ΔfC分别表示细菌和CPC的频率变化;
d)每单位细菌的吸附质量η=ΔfC/ΔfB=ΔmC/ΔmB,其中ΔmC是CPC的吸附质量,ΔmB是细菌的吸附质量;
e)具有不同PEG接枝比例的荧光标记的CPC-1和金黄色葡萄球菌在静态培养物中培养1小时的荧光图像。细菌的荧光强度与CPC-1的EPEG接枝率成反比。比例尺,10μm;
f)Hill指数,n=5,表明纤维CPC-1与细菌表面有强烈的多位点结合;
g)CPC-3对细菌的多位点结合模式示意图;
h)用球形CPC-2和纤维CPC-3培养1小时的金黄色葡萄球菌的SEM图像。黄色和红色箭头分别表示纳米颗粒和纳米纤维。比例尺,500 nm。
图5 体外CPCs的抗菌活性
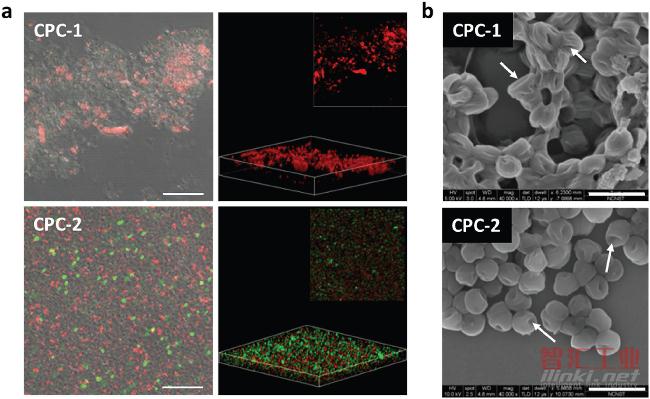
a)培养在明胶酶阳性细菌(革兰氏阳性菌,金黄色葡萄球菌)的CPC-1(顶部)和CPC-2(底部)杀伤效力的2D和3D共聚焦显微镜图像。 比例尺,10μm;
b)用CPC-1(顶部)和CPC-2(底部)(300×10-6 M)培养6-8小时的金黄色葡萄球菌的形态,箭头表示细菌膜的损伤,塌陷和融合。 比例尺,2μm。
图6 体内CPCs的累积、保留及其抗菌性
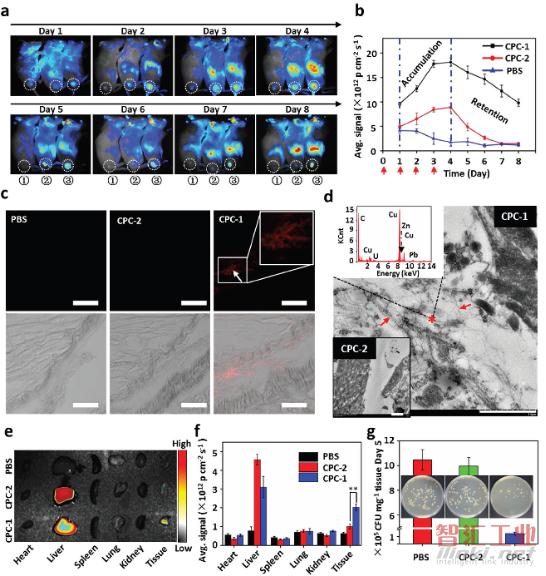
a)注射①PBS后的金黄色葡萄球菌的体内近红外荧光成像,②CPC-2,③CPC-1。使用PBS缓冲溶液(pH 7.4)作为对照。白色的圆圈表示感染部位;
b)感染部位在不同时间的平均荧光信号。红色箭头表示在第0天,第1天,第2天和第3天进行注射;
c)注射PBS,CPC-2和CPC-1的小鼠感染组织切片的CLSM图像。箭头表示纤维状荧光信号。插入图是白色箭头区域的高倍率图像。比例尺,100×10-6m;
d)与用CPC-2(下方插入图)处理后的感染部位相比,尾静脉内注射8天CPC-1后,在金黄色葡萄球菌感染部位形成的纳米纤维的TEM图像。箭头表示纤维结构。比例尺,1μm。在感兴趣区域获取的相应的能量色散图在图d(上方插入图)中由红色星标记;
e)由PBS,CPC-2和CPC-1后处理8天的组织和主要器官的体外近红外荧光图像;
f)尾静脉注射8天后主要器官的平均荧光信号。平均荧光信号值表示为平均值±S.D(N=6)。星号(**)表示**P<0.01的统计学意义;g)在第5天对在感染区域存活的金黄色葡萄球菌进行量化。插入图表示注射有PBS,CPC-1和CPC-2的小鼠感染组织的细菌菌落。误差线由每组5只小鼠确定。
【小结】
王浩研究员等人开发了一种含有明胶酶裂解EPEG和抗菌肽KLAK的CPCs,其在反应过程中自组装成纳米颗粒。CPC-1的重组通过暴露的KLAK和细菌膜之间的多位点协同静电结合模型,显著提高了纳米材料与细菌之间的相互作用,抗菌功效明显增强。与不变型CPC-2相比,可转化的CPC-1的保留时间更长且体内抗菌性能更佳。
(审核编辑: 林静)



