结合我国血液制品生产现状,同时参照国外血液制品的发展规律,要求国内企业拥有先进的技术,能够有效地从同一批血浆中分离尽可能多种类的蛋白。未来凝血因子和免疫球蛋白(尤其是IVIG)在国内将有更大的发展空间。
本文根据血液制品的生产工艺流程, 合理进行空间及平面布局, 降低交叉污染的风险。结合实践,探讨工程设计的几个要点。
1血液制品概况
血液制品种类
血液制品即人血浆蛋白制品(Plasma protein product)是国家战略资源,在战伤抢救、医疗急救(创伤失血、烧伤)、临床疾病(血友病、肝脏疾病等)中有着其他药品不可替代的作用,属于较为刚性的药品 [1]。血液制品包括如下几类:①人血白蛋白(HA);②免疫球蛋白类(IgG),含静脉注射人免疫球蛋白(IVIG)、肌内注射人免疫球蛋白(IMIG)、特异性人免疫球蛋白;③凝血因子类即小制品类,含八因子(FVIII)、九因子(FIX)、纤维蛋白原(Fibrinogen,FG)、凝血酶(Thrombin,TB)、凝血酶原复合物(Prothrombin complex,PCC) 等;④蛋白酶抑制剂等其他血浆蛋白制品。
国内外血液制品格局
国外血液制品产业起源于20世纪40年代,之后的发展经历了三个阶段,每个阶段的发展驱动力不同:
(1)1940~1980 HA是行业增长的主要驱动力 。
(2)1980~2000 FVIII开始商业化,逐渐成为新的行业驱动力 。
(3)2000年至今由于FVIII和FIX被重组产品取代,IVIG 逐渐接力,成为新的行业驱动力。
目前,国外已批准上市的血制品种类约为40种左右。其中HA仅占市场结构的13%,其他87%为免疫球蛋白类和凝血因子类产品,产品种类较丰富。相比之下,我国CFDA批准的国产血液制品仅10种左右,且HA占据一半的市场份额,产品种类单一。
血液制品行业有一条很简单的规律——产品线越丰富,利润率越高。因为生产血液制品的原料都是一批血浆,因而如果能从一批血浆中提取更多种产品就能够有效地摊薄成本。国外一批浆能够产出22到24个产品,但中国通常情况下是7到9个(国内仅有三家公司提取10~11个) ,少的只有3~4个。血浆综合利用率低、上市品种少是我国血液制品行业的现实[2]。
和国外相比,制约我国血液制品发展的因素有:
①我国血浆来源较为紧缺,这和我国较为严格的政策有关。保证充足而高质量的原料血浆供应是血液制品工业发展的先决条件。
②我国生产技术水平与发达国家相比存在较大差距,特别是重组技术的落后导致我国血液制品规模远小于美国等发达国家。本文将对血液制品项目中工艺设计进行探讨,并总结工程设计中的几个要点。
2生产工艺
血浆的组成
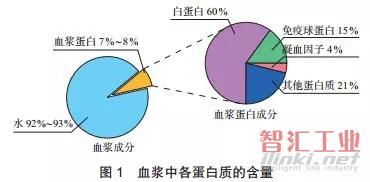
血液制品的原料是人血浆(本文不考虑重组蛋白),血浆中各蛋白含量如图1所示:人血浆中有92%~ 93%是水,仅有7%~8%是蛋白质,而这部分蛋白质中约60%是白蛋白,约15%是免疫球蛋白,凝血因子占4%左右,其他蛋白质约占21%。血液制品就是从这部分血浆蛋白中分离、 纯化、精制而成。
工艺流程
由血浆制备血液制品的生产工艺流程可简述如图2所示(无菌分装及其以下工艺流程本文不做详述)。
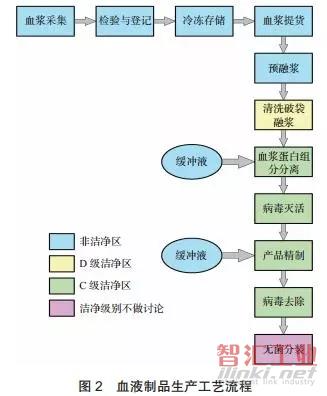
1、血浆采集、检验与登记、冷冻存储、血浆提货原料血浆的采集单位应为法定部门批准的单采血浆站,企业在接收原料血浆时,应按照规定对每批血浆进行检验和登记,如病毒检测、原料血浆在运输过程中的温度监控检查等。检验合格的原料血浆送入冷库存储,一般冷库要求温度为 -30℃~-25℃。原料血浆在提货使用前,应再次对每批血浆进行质量评价, 检验合格后方可进入生产区投产使用[3]。
2、血浆蛋白组分分离、产品精制血浆蛋白组分分离主要采用的是经典低温乙醇沉淀法, 其原理是利用蛋白质理化性质差异:不同种类的血浆蛋白在不同浓度的乙醇中溶解度不同, 通过加入不同浓度的乙醇来改变蛋白质的稳定性,从而达到分离各组分的目的[4]。
目前,血浆蛋白的粗制与精制主要采用经典的低温乙醇沉淀分离法加压滤法、吸附法、层析法、超滤法。对于一些工艺复杂、分离纯化困难的产品,如小制品,需要反复多次运用超滤法、层析法等才能最终得到理想的产品。
3、病毒灭活、病毒去除
由于血液制品主要从人血浆中提取,原材料的特殊性使得血液制品可能因产品质量问题、安全问题导致交叉感染、血源性疾病传播等重大医疗事故,所以血液制品一定要灭活和去除病毒,生产过程中应有特定的灭活和去除病毒的方法。
目前被国内血液制品企业广泛使用的灭活方法有巴氏消毒法、S/D灭活法、低pH值孵放法、辛酸灭活法、干热灭活法(适用于制剂,本文不做讨论)等。病毒作为一种异源蛋白,如果随血液制品进入人体会产生不良反应。另一方面, 由于技术水平的限制,目前的病毒灭活方法只对已发现的病毒有效,不能保证对未发现的病毒有灭活效果。所以,仅仅灭活是无法保证血液制品安全性的,需要将其从产品中去除。目前较为常用的病毒去除方法是膜过滤法和层析法[1]。在实际的工艺生产中,通常将两种或两种以上的病毒灭活和去除方法并用, 以达到安全有效的目的。以下是不同产品常用的病毒灭活和去除方法,见表1[5]。

平面布局
根据GMP要求,血液制品的生产厂房应为独立建筑物,不得与其他药品共用,并使用专用的生产设施和设备。通常一个血液制品生产厂房应包括核心生产区、共用工程辅助区(如洁净公用工程间、空调机房、冷冻站、空压机房、配电间等)和其他生产辅助区等(更衣间、洗衣间、清洗间、洁具间等) 。
核心生产区的区域划分按照生产工艺流程的单元操作集中成区。根据血液制品生产流程, 可划分如下几个生产单元:融浆区、各蛋白组分粗分离区、HA粗制与精制区、IgG粗制区、IgG 精制区、凝血因子粗制区、凝血因子精制区、无菌原液制备转移区。
根据GMP要求,核心生产区主要工艺操作在C级洁净级别下进行,融浆区和各个生产单元的清洗功能间为D级洁净级别。各个生产单元设有独立的人员和物料进出通道,同时这种根据单元操作集中成区的设计思路,可以减少生产中的迂回返折,最大限度地降低生产中的交叉污染等风险。

因血液制品生产工艺较为复杂,特别是对于在同一单体内生产多种产品的厂房,需合理进行工艺布局,避免生产线交叉,努力做到物流路线最短。一般考虑至少两层模式建设厂房。现以图3所示的三层模式设计为例:三层主要布置破袋融浆区、血浆蛋白组分粗制区(病毒灭活前)、缓冲液配制区;二层主要布置血浆蛋白组分精制区(病毒灭活后)、无菌原液制备转移区;一层主要布置制剂生产区。根据 GMP要求,血浆融浆区域、组分分离区域以及病毒灭活后生产区域应当独立设置[1],这种三层模式的设计,从物理上将病毒灭活前后隔断, 降低了污染的风险。
但是有一点值得注意,小制品的灭活方式为不完全灭活,故其在二层精制的区域应与二层其他产区精制区域严格分开设置。从纵向来看,这种三层模式设计中物料流向自上而下,较为合理。
血液制品生产的一个特点就是用到的缓冲液种类繁多。如何将上百种缓冲液合理配制,并尽可能通过较短的管线输送到各使用罐中成为一个难点。对于用量较大的缓冲液,可采取车间集中配制,管道输送的方式,这样不仅可以节省缓冲液配制空间和设备,而且可以降低能耗,减少生产运营成本。对于用量较小的缓冲液,可采取各个生产单元就地配制的方式。
根据这种设计思路,在三层布置了中央缓冲液配制区、储存区以满足各个生产单元对大批量缓冲液的需求。同时,在各生产单元均单独设置一间缓冲液配制区,以满足各生产单元对小批量缓冲液的需求。
3工程设计的几个要点
注射水系统设计
血液制品生产车间有数以百计的注射用水高温使用点、常温使用点和低温使用点。如果按照常规的注射用水系统“高温循环,末端降温”的思路来设计,那么所需的换热器数量太多, 而且许多用点需要两级换热才能保证末端使用温度。无论从设备成本考虑还是从运营成本来看,这都是巨大的投资。针对这种情况,可以采取如下几种注射用水输送系统[6] :
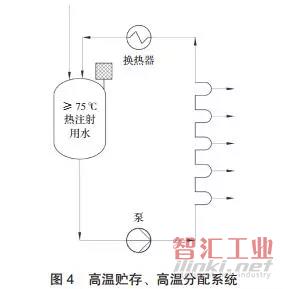
A. 高温贮存、 高温分配
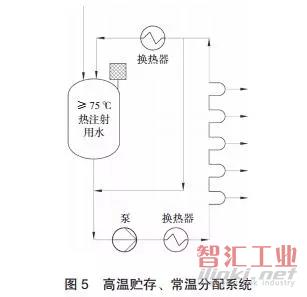
B. 高温贮存、 常温分配
C. 低温贮存, 低温分配
D. 单路系统分配
A. 高温贮存、高温分配系统(见图 4)是目前常用的注射水分配输送系统,其制备的是高温水, 使用点所需的也是高温水。此种系统能够严格地控制微生物滋生。
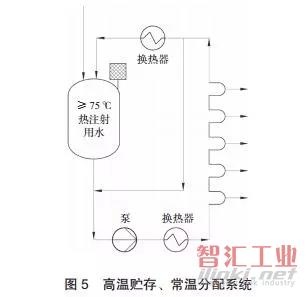
B. 高温贮存、常温分配系统(见图 5)适用于常温水需求较大的场合。此系统分为白天工作时段工况和夜间热循环工况两种。白天工作时 其制备的是高温水,经换热器降至常温到达各使用点。夜间非工作工况时,整个系统高温循环,避免微生物的滋生。
C. 低温贮存, 低温分配系统(见图 6)适用于低温水需求较大的场合。此系统分为白天工作工况和夜间热循环工况两种。白天工作时,其制备的是低温水,使用点所需的也是低温水。夜间非工作工况时,整个系统高温循环,避免微生物的滋生。
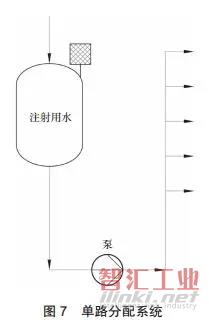
D. 单路分配系统(见图 7),适用于用水量很大且持续用水的场合。对于单层面积较大、所需注射用水系统管线较长的情况,可在每层根据使用点的物理位置设置若干贮存分配系统,使单个循环系统管线长度不大于400m,泵的扬程选型适当。
低温房间的设计
血液制品的部分功能房间如科恩区、压滤间、冷藏室及部分工艺操作间要求在低温环境中操作。进出这些房间需设置缓冲间。如需在这些低温房间设置观察窗,则需做好窗体密封,以避免水蒸气进入双层玻璃内并结露影响观察效果。同时,要做好墙体和地面保温,对于位于二层和三层的房间来说,也要做好楼板保温,防止楼板结露。
防爆区的设计
血液制品中用到了大量的95%乙醇,因此将乙醇贮存区域和用量较大的科恩区域设为防爆区。 防爆区布置在单体边侧,利于泄爆。防爆区内设置危险气体探测装置。
4结束语
结合我国血液制品生产现状,同时参照国外血液制品的发展规律,要求国内企业拥有先进的技术,能够有效地从同一批血浆中分离尽可能多种类的蛋白。未来凝血因子和免疫球蛋白(尤其是IVIG)在国内将有更大的发展空间。
参考文献
[1] 宋清爽,吴恩应,张运佳等。 血液制品病毒灭活及去除工艺进展[J].生物技术通讯,2012,23(4):627-630.
[2] 王卓,赵雄,吕茂民等。血液制品的现状与展望[J].生物工程学报 . 2011,27(5):730-746.
[3] 药品生产质量管理规范(2010年修订)附录 4[S].
[4] 周耀东.血液制品生产工艺特点及生产车间平面规划设计[J],甘肃科技,2008,24(3):116-119.
[5] 杨勇,董秀芳,邢志等.血液制品生产厂房设计特点[J]化工与医药工程,2016,37(2):20-24.
[6] ISPE[M]. Baseline Guide:Water and Steam System, Volume 4.
作者:黄洁,福斯特惠勒(河北)工程设计有限公司
(审核编辑: 智汇小新)



