2019年,FDA的药品评价和研究中心(CDER)批准了48个NDA和BLA申请,以及96个首仿药;48个首次NDA和BLA申请中有37个新分子实体,21个a孤儿药,24个药获优先评审。
根据《FDA安全与创新法案》(GAIN),新抗生素Fetroja(治疗复杂尿路感染)、Xenleta(治疗社区获得性细菌性肺炎)、抗结核新药Pretomanid、Zerbaxa(治疗医院获得性细菌性肺炎和呼吸机相关细菌性肺炎)和Recarbrio(亚胺培南、西司他丁和Relebactam三药联合注射液,治疗成人复杂尿路感染和复杂腹腔感染)获得FDA授予合格传染病产品(QIDP)称号。开发Pretomanid的全球结核病药物开发联盟还获得一张热带病优先审查券。
首个针对杜氏肌营养不良突变罕见病的靶向治疗药物Vyondys 53被FDA授予优先审查和孤儿药指定。此外,FDA奖励开发公司Sarepta Therapeutics Inc一张罕见儿科疾病优先审查券。
因为囊性纤维化新药Trikafta带给广大囊性纤维化患者的获益,FDA授予Trikafta所有可用的指定,包括优先审评、快速通道、突破性治疗和孤儿药,以最有效的方式推进了批准,用时3个月就完成审批,提前了近5个月。同时FDA奖励Vertex公司一张罕见儿科疾病优先审评劵。
Genentech公司的Rozlytrek(Entritinib,治疗携带NTRK(神经营养受体酪氨酸激酶)基因融合肿瘤)是FDA批准的第三个基于不同类型肿瘤的共同生物标志物而非肿瘤起源部位的癌症治疗。这项批准标志着“tissue agnostic(组织不可知*)”癌症药物开发的新模式。另两个药物分别为:2017年的Pembrolizumab,治疗微卫星不稳定高(MSI-H)或错配修复缺陷(dMMR)肿瘤;2018年的Larotretinib,治疗NTRK基因融合肿瘤。
诺华公司的Piqray(alpelisib)是第一种用于乳腺癌的PI3K抑制剂,也是第一个根据实时肿瘤学审查(RTOR)试点计划批准的新分子实体。RTOR允许FDA在正式提交申请之前开始分析关键疗效和安全数据集,允许审查小组更早开始审查并与申请人沟通。Piqray还使用了最新的评估辅助(AAid),这是一个多学科审查模板,旨在将FDA的书面审查集中在批判性思维和一致性上,并减少花在行政任务上的时间。批准Piqray的时间比处方药使用费法案VI(PDUFA)目标日期提前了大约三个月。
首个口服GLP-1药物,诺和诺德的Rybelsus索马鲁肽口服片获批,这是第一个无需注射的胰高血糖素样肽(GLP-1)受体激动剂治疗药物,用于2型糖尿病患者的非胰岛素治疗。而礼来公司(Eli Lilly)的Baqsimi鼻粉末吸入剂则是首个获批的无需注射即可用于紧急治疗严重低血糖症的胰高血糖素疗法。
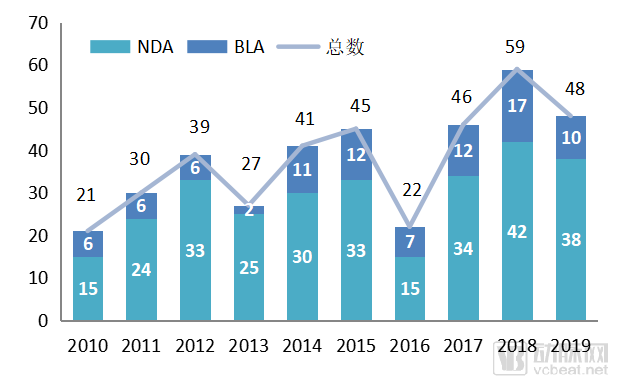
图一、2010-2019年CDER批准新药数
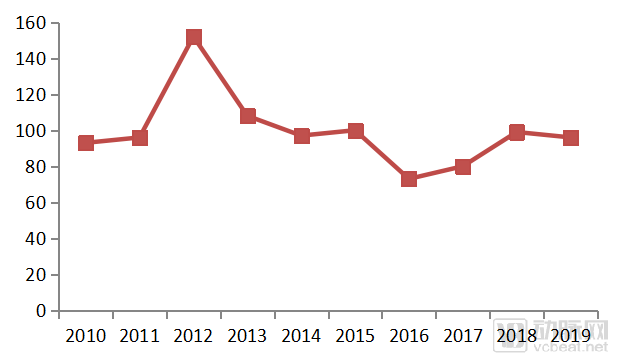
图二、2010-2019年CDER批准首仿药数
2019年2月FDA出台《竞争性仿制药指南》(Competitive Generic Therapies,CGT),目的是通过政策支持激励医药企业开发对竞争不足药物的仿制药。据2017年颁布的FDA再授权法案,如在FDA“橙皮书”中只有不超过一种已批准药物,该药物将被认为仿制药竞争不充分,提交此类药物的仿制药申请可以获得CGT资格认定。
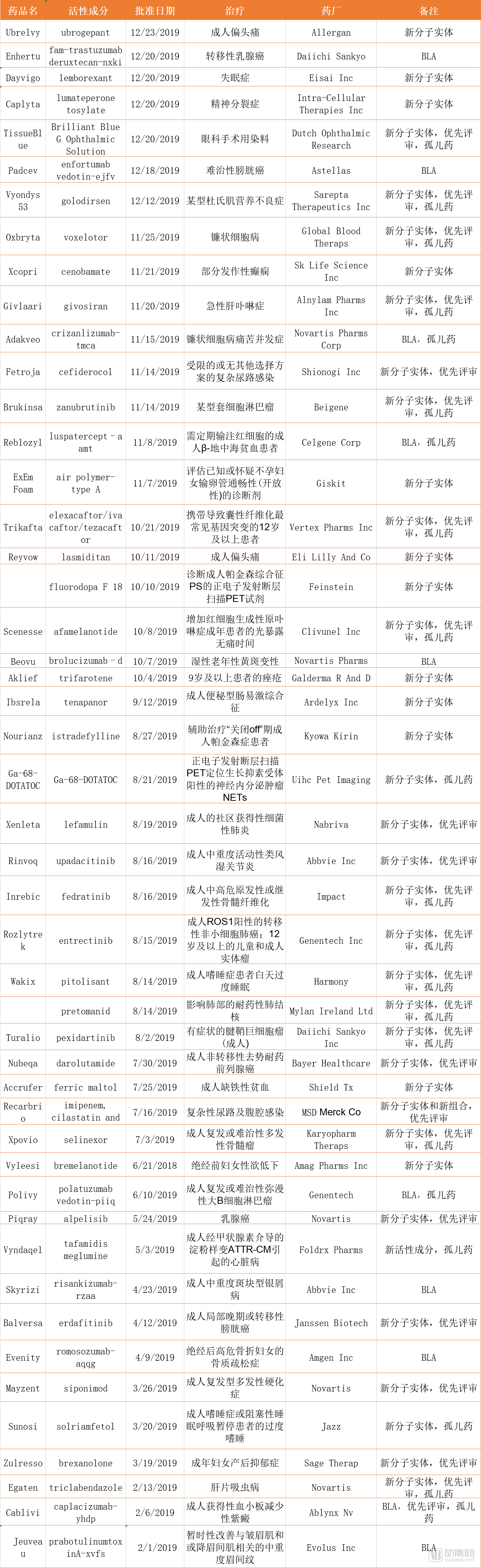
表一、48个NDA和BLA申请
2019年,FDA的生物制品评估和研究中心(CBER)批准了21个BLA申请、3个NDA和ANDA申请。其中有3个疫苗类产品(首个预防天花和猴痘的活性疫苗、首个预防埃博拉病毒的疫苗和登革热四价活疫苗),以及基因疗法Zolgensma。
FDA授予首个预防埃博拉病毒的疫苗ERVEBO优先审查和突破性疗法,在不到6个月的时间内完成了对Ervebo安全性和有效性的评估,并奖励一张热带疾病优先审查券给开发该疫苗的Merck公司。
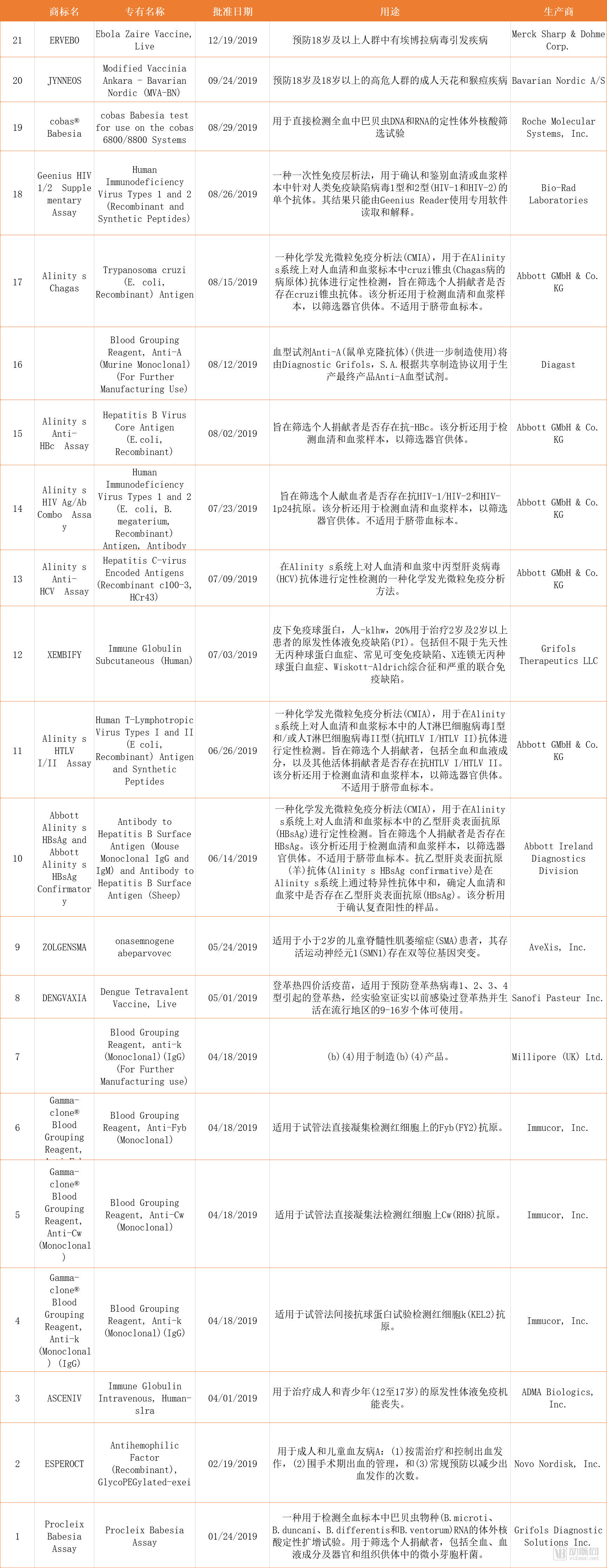
表二、20个BLA申请

表三、3个NDA和ANDA申请
(审核编辑: candice)



